Multivalente Glycokonjugate und
das Geheimnis der Glycocalyx
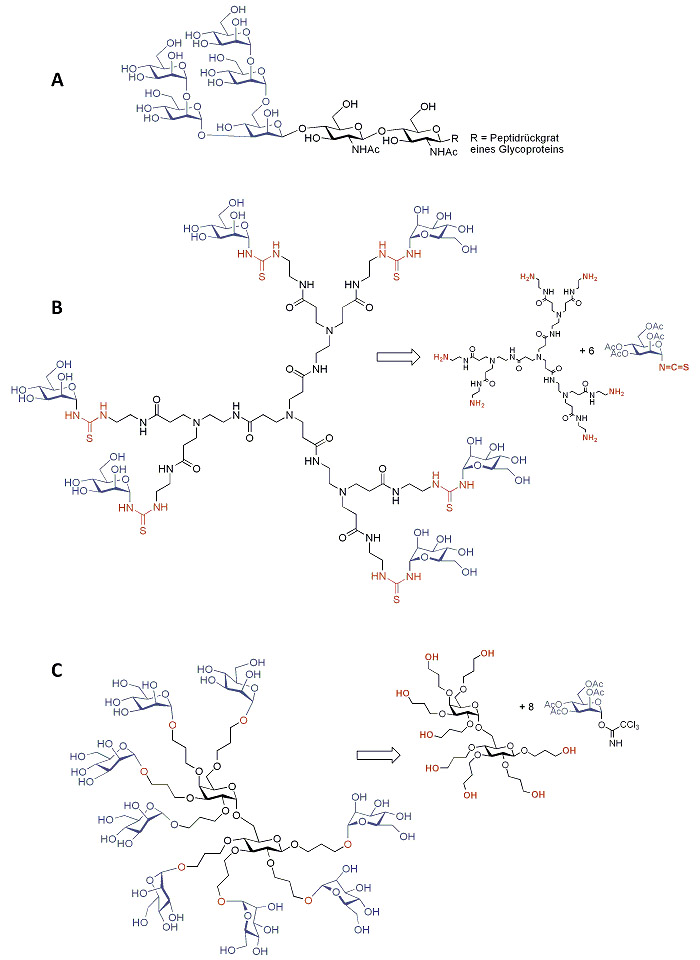
Abbildung 1: Hier geht es um Mannose (in Blau). Mannose ist ein wichtiger Teil oligoantennärer Glycoproteine auf der Zelloberfläche (wie in A) und wird dort von spezialisierten Proteinen, den Lektinen, erkannt und komplexiert. Auch Bakterien nutzen eigene Lektine zum Zwecke der Adhäsion an die Wirtszelloberfläche. Thioharnstoff-verbrückte Glycodendrimere (B) können solche natürlich vorkommenden Oligosaccharide mimikrieren und beispielsweise als Inhibitoren bakterieller Adhäsion eingesetzt werden, ebenso wie die „Octopus-Glycoside“ (C). Glycodendrimere lassen sich z.B. durch die Reaktion von hochverzweigten Polyaminen (hier ein kleines Polyamidoamin-(PAMAM-)Dendrimer) mit Glycosylisothiocyanaten herstellen. Octopus-Glycoside haben wir durch Glycosylierung Kohlenhydrat-zentrierter Polyole erhalten. Die künstlich entworfenen Glycokonjugate vom Typ B und C sind Vertreter sogenannter multivalenter Glycomimetika, die in den Glycowissenschaften benötigt werden um den Funktionen von Zuckern bei der Zellkommunikation auf die Spur zu kommen. Vgl. dazu: M. Dubber, O. Sperling, Th. K. Lindhorst, Org. Biomol. Chem. 2006, 4, 3901-3912.
Alles schöne Moleküle, aber wozu? Die Frage ist berechtigt. Man muss wissen, dass Kohlenhydrate und Glycokonjugate jede Zelloberfläche dekorieren. Eine dicke, bis über 100 Nanometer Raum greifende Schicht umgibt auch alle Säugetierzellen. Diese Schicht wird Glycocalyx genannt. Die Glycokonjugat-Bestandteile der Glycocalyx sind kompliziert, hochverzweigt, multivalent gebaut und sie übernehmen ganz unterschiedliche, immer essentielle Funktionen bei der Kommunikation zwischen Zellen. Vieles in diesem Geschehen wird sozusagen in Gang gesetzt von spezialisierten Proteinen, die Kohlenhydrate spezifisch erkennen und komplexieren können, die Lektine. Die Wechselwirkungen zwischen Lektinen und ihren Kohlenhydrat-Liganden allerdings sind, wenn man sie ex vivo misst, besonders schwach mit Dissoziationskonstanten im millimolaren Bereich. Da leuchtet es nicht ein, wie ihnen eine wichtige biochemische Rolle zukommen kann. Allerdings sind so gut wie alle diese Lektin-Zucker-Wechselwirkungen multivalent angelegt und dies ermöglicht offensichtlich erst ihre Wirksamkeit bzw. vermittelt ihre Funktionsweise. Um dem Rätsel der Multivalenz bei der Kohlenhydraterkennung auf die Spur zu kommen, benötigt man Moleküle, mit denen man ganz dezidierte Fragen experimentell adressieren kann: multivalente Glycomimetika wie die Glycodendrimere. Ich habe viele Ideen und Gedanken zum Rätsel der Multivalenz in der Glycobiologie und zur Natur der Kohlenhydrat-Erkennung auf Zelloberflächen im Hinterkopf. Es scheint bisher ein gut gehütetes Geheimnis, was das Wesen der Glycocalyx ist. Ich las kürzlich über die Unschärfe der Struktur der Zellmembran (Science 2010, 327, 46-50). Ähnliches sollte man einmal über die Zelloberfläche denken: Danach würde eine Änderung der Verhältnisse der Glycocalyx schon dadurch induziert, dass man versucht sie zu beobachten. Das könnte genau so sein und wenn es stimmt, dann ist es höchste Zeit, sich ein passendes Experiment einfallen zu lassen, um das Geheimnis zu enthüllen.
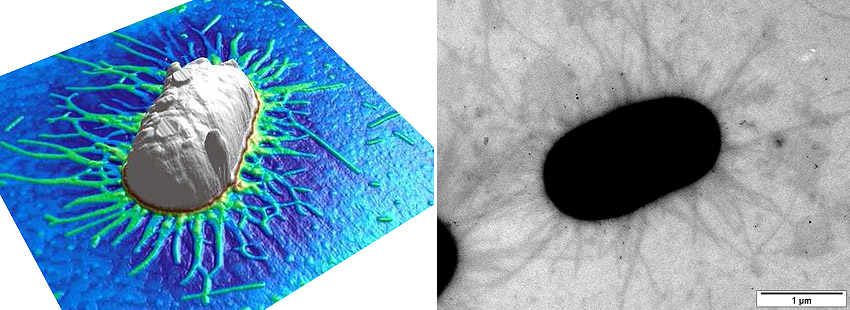
Abbildung 2: links: Rasterkraftmikroskopisches Bild eines E. coli-Bakteriums, das mit Hilfe seiner Fimbrien an einer adhäsiven Oberfläche anhaftet.
rechts: Elektronenmikroskopische Aufnahme Typ-1-fimbrierter E. coli-Bakterien. Die durch Typ-1-Fimbrien vermittelte Adhäsion von Bakterien lässt sich durch multivalente Mannose-dekorierte Glycomimetika verhindern, was viele Anwendungsmöglichkeiten in Technik und Medizin zulässt.
Vgl. dazu: Th. K. Lindhorst: Ligands for FimH, In: Synthesis and Biological Applications of Glycoconjugates, O. Renaudet, N. Spinelli (Eds.), Bentham eBooks, 2011, 12-35.
open access
Viele der von uns erfundenen multivalenten Glycomimetika haben wir dazu verwendet, Zell-Zell-Interaktionen am Beispiel der Adhäsion von Bakterien zu untersuchen. Bakterien nutzen adhäsive Organellen, -Fimbrien oder Pili genannt-, die wie Haare ihre Oberfläche bedecken, um die Anheftung an die glycosylierte Oberfläche ihrer Wirtszellen zu ermöglichen (Abbildung 2). Das erlaubt Adhäsion, Kolonisation, Biofilmbildung und auch Internalisierung von Mikroben, was oft mit erheblichen Einbußen für den Wirtsorganismus verbunden ist. Fimbrien enthalten Lektinabschnitte mit unterschiedlichen Kohlenhydratspezifitäten. Wir haben sehr genau die a-D-Mannose-Spezifität von Typ-1-fimbriierten uropathogenen Escherichia coli-Bakterien (UPEC) untersucht und dabei viele Details entdeckt, die den Rahmen dieses Beitrages sprengen. Wir sehen, dass die Fimbrien-vermittelte bakterielle Wechselwirkung mit Zuckern in Lösung anders geartet ist, als auf Oberflächen und wir sehen, dass die wirksamen adhäsiven Kräfte abhängen von den Scherkräften, die herrschen: Steigt der „flow“ nimmt bei Typ-1-Fimbrien die adhäsive Kraft noch zu, nach einem strukturbiologischen Prinzip, das als „Catch bond-Mechanismus“ bezeichnet wird. Praktisch gesprochen haften UPEC bei engagiertem Urinfluss noch fester an die Glycocalyx ihrer Wirtszellen als wenn keine Scherkräfte wirken. Man kann sich ausmalen, welche Implikationen diese Tatsache haben kann. Die Natur steckt voller Wunder, und dabei sind die Kohlenhydrate immer meine Spezialität geblieben. Mein Fach, die Biologische Chemie, kann zum Verständnis der Natur zweifellos Beiträge leisten, aber andere Disziplinen, andere Denkungsarten müssen einstimmen. Es ist meine Überzeugung, dass es auch Männer wie Frauen gleichermaßen braucht damit aus den diversen Tönen, die um uns herum erklingen, eine Melodie wird. Es ist für die Entwicklung unserer Gesellschaft wichtig, dies zu verstehen. Chauvinismus ist die Denkungsart von gestern und heute sehen wir nach vorne in eine Forschungslandschaft, die von Chancengleichheit auf allen Gebieten belebt werden kann.
 |
CV | Prof. Dr. Thisbe K. Lindhorst |
| 19.11.1962 | geboren in München. | |
| 11/1981 - 2/1985 | Chemiestudium, Ludwig-Maximilians-Universität München. | |
| 4/1985 - 2/1988 | Chemiestudium, Biochemieschwerpunkt, Westfälische Wilhelms-Universität Münster. | |
| 1/1988 - 9/1988 | Diplomarbeit, Arbeitskreis von Prof. Dr. J. Thiem, Münster, "Synthese von l-Fucose-Derivaten zum Aufbau desoxygenierter Fucosylphosphate“. | |
| 10/1989 - 3/1991 | Dissertation, Universität Hamburg, Arbeitskreis von Prof. Dr. J. Thiem, Hamburg, "Die Synthese von l-Fucose-Derivaten als potentielle Inhibitoren und Modulatoren des GDP-β-L-Fucose-Stoffwechsels" | |
| 1991 | Geburt meines Sohnes Moritz Maximilian. | |
| 2/1992 - 4/1993 | Postdoc, DFG-Stipendium, University of British Columbia in Vancouver, Canada, Prof. Dr. St. G. Withers, Glycosidaseinhibitoren und Enzymologie. | |
| 10/1993 – 11/1998 | Habilitation am Institut für Organische Chemie der Universität Hamburg Universität. | |
| 1995 | Geburt meines Sohnes Justus Emanuel. | |
| 1998, 1999 | Venia Legendi und Privatdozentur, Hamburg. | |
| Seit 1/2000 | Professur (C4) für Organische/Biologische Chemie, Christian-Albrechts-Universität zu Kiel. | |
| Auszeichnungen und Ämter – Auswahl | ||
| 1998 | Förderpreis der Karl-Ziegler-Stiftung | |
| 1998 | Chemiepreis der Akademie der Wissenschaften zu Göttingen | |
| 2000 | Carl-Duisberg-Gedächtnis-Preis | |
| 2000 | Travel Award zum 1st German-American Frontiers of Chemistry Symposium, Kloster Seeon, Germany. | |
| 2002 | Travel Award zum 2nd German-American Frontiers of Chemistry Symposium, Durham New Hampshire, USA. | |
| 2002-2006 | Vorsitzende des Fakultätsausschusses Chemie an der CAU zu Kiel | |
| 2002-2010 | Mitglied des Wissenschaftlichen Beirats des Forschungszentrums Borstel | |
| 2005-2011 | Mitglied und Stellvertretende Vorsitzende der Liebig-Vereinigung für Organische Chemie (GDCh) | |
| 2008/2009 | Mitglied der Evaluierungskommission des Research Council of Norway (RCN): Evaluation of Basic Chemistry Research Norway | |
| Seit 2008 | GDCh-Ortsgruppenvorsitzende | |
| Seit 2010 | Kuratoriumsmitglied bei den Nachrichten aus der Chemie | |
| Seit 2010 | Chemie-Fachkollegiatin der DFG | |
| Seit 2011 | 2. Vorsitzende des AKCC | |
| Seit 2012 | GDCh-Vorstandsmitglied | |